پیوند های شیمیایی چه نقشی در زندگی انسان ها دارند...
انواع پیوندهای شیمیایی به شرح زیر می باشند: پیوند کووالانس ،پیوند کئوردینانسی، پیوند فلزی،پیوند هیدروژنی
پیوند کووالانسی :
چیزی در حدود 100 عنصر در اطراف ما وجود دارد که ما نمی توانیم آن ها را در حالت خالص شان پیدا کنیم و این مسئله، بیشتر به علت خاصیت واکنش پذیری بالای آن عناصر می باشد. در واقع این عناصر برای تشکیل مواد و اجسام ساده و یا پیچیده با یکدیگر برهم کنش می کنند و در این جا تنها عناصری میل به ترکیب ندارند که آرایش الکترونی اربیتال های آن ها و یا لایه های الکترونی شان پر شده از الکترون است که گازهای نادر یا نجیب یا بی اثر نامیده می شوند.
در واقع چنین ساختاری باعث پایداری هر چه بیشتر عنصر می گردد که به دنبال آن خاصیت واکنش پذیری کمتر می شود. سایر عناصر نیز که دارای چنین ساختاری نیستند، برای رسیدن به آرایش الکترونی کامل و بدست آوردن آن تلاش می کنند.
آن ها در واقع این پیکربندی و یا آرایش الکترونی کامل را از طریق ترکیب شدن با همدیگر یا کسب و یا از دست دادن انرژی، به دست می آورند. بنابراین واکنش پذیری شیمیایی هر عنصر با تعداد و نحوه ی توزیع الکترون ها در اتم های آن عنصر و نیز تغییرات درگیر در واکنش، مرتبط می باشد.
می توان نتیجه گرفت که سطح پایین انرژی یک سیستم ( سامانه )، منجر به پایداری هر چه بیشتر آن سیستم می شود.
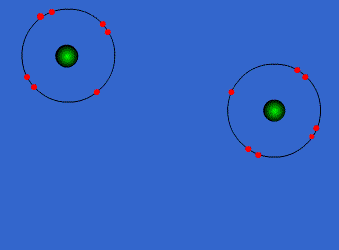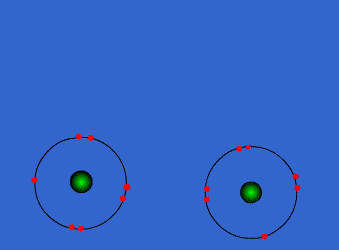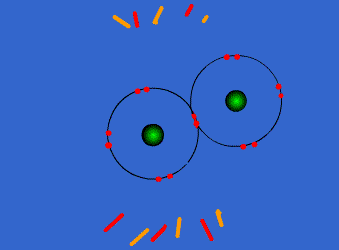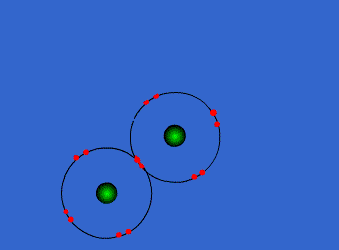
اتم ها برای رسیدن به آرایش پایدار الکترونی گاز نجیب که دارای آرایش هشتایی است، از لایه های بیرونی استفاده می کنند. در این جا اتم ها با به اشتراک گذاشتن یک یا تعداد الکترون های بیشتری در دورترین لایه ی الکترونی نسبت به هسته، اقدام به تشکیل پیوند می کنند. این پیوند که از اشتراک الکترونی متقابل حاصل می گردد، پیوند کووالانسی نامیده می شود.
میلیونها ماده مرکب شناخته شده است که فقط از غیر فلزات ترکیب یافتهاند. این مواد مرکب فقط شامل عناصری هستند که در هر اتم 4، 5 ،6 یا 7 الکترون والانس دارند. بنابراین الکترونهای والانس اتمهای غیر فلزی ، آنقدر زیاد است که اتمها نمیتوانند با از دست دادن آنها ساختار یک گاز نجیب را به دست آورند. معمولا غیر فلزات با جفت کردن الکترونها پیوند ایجاد میکنند و در این فرآیند به ساختار یک گاز نجیب میرسند.
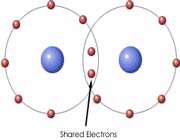
یکی دیگر از راه هایی که یک اتم میتواند به آرایش الکترونی پایدار برسد، این است که با یک یا چند اتم دیگر الکترون به اشتراک بگذارد. هنگامی که دو اتم الکترون به اشتراک میگذارند، نیروی جاذبهای بین آنها بوجود میآید که سبب به هم پیوستن آن دو اتم به یکدیگر میشود و این نیروی جاذبه به پیوند کووالانسی نام دارد. آنچه اتمهای یک ملکول را به هم نگه میدارد، پیوند کووالانسی است،
در تشکیل پیوند کووالانسی الکترونها ، به جای آنکه از اتمی به اتم دیگر منتقل شوند، میان دو اتم به اشتراک گذاشته میشوند. استحکام پیوند کووالانسی ناشی از جاذبه متقابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. یا به عبارت دیگر مربوط به آن است که هر دو هسته الکترونهای مشترکی را جذب میکنند.
شرط تشکیل پیوند کوولانسی: لازمه تشکیل پیوند کوولانسی بین دو اتم ، این است که هر یک از دو اتم در آخرین تراز انرژی خود لااقل یک اوربیتال نیمه پر داشته باشند.
با تشکیل این پیوند، هر کدام از اتم های درگیر در ساخت پیوند، به پایداری می رسند. ترکیباتی که از طریق پیوندهای کووالانسی تشکیل شده اند، ترکیبات کووالانسی نام دارند.
پیوند یونی:
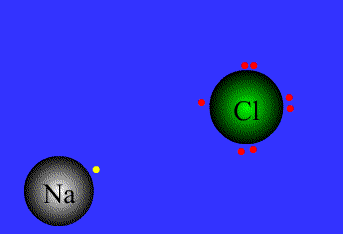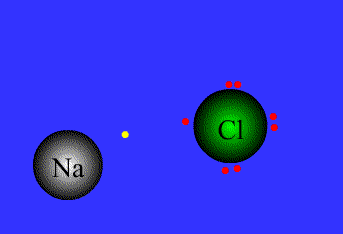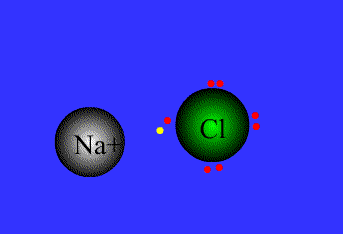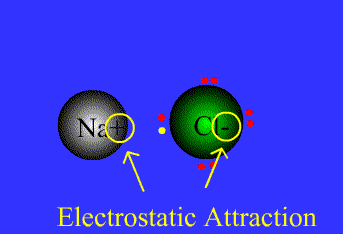
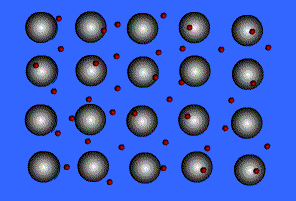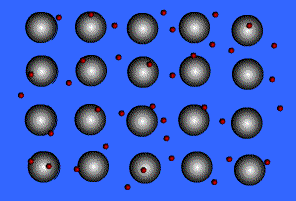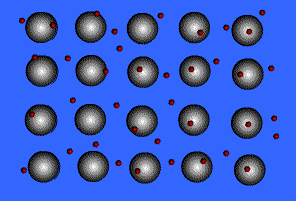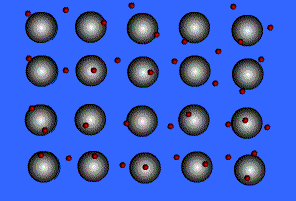
- پیوند یونی: نیروی جاذبه قویی است که بین یونهای با بار مخالف وجود دارد. این پیوند نتیجهی انتقال الکترون از اتم فلز به اتم نافلز است. پیوند یونی را پیوند الکترووالانسی نیز مینامند. ترکیبات یونی متشکل از تعداد زیادی آنیون وکاتیون هستند که با طرح معین هندسی در کنار هم قرار گرفتهاند و یک بلور بوجود میآورند.
. هر بلور ، به سبب جاذبههای منفی ـ مثبت یونها به هم ، نگه داشته شده است. فرمول شیمیایی یک ترکیب یونی نشانه ساده ترین نسبت یونهای مختلف برای به وجود آوردن بلوری است که از نظر الکتریکی خنثی باشد.
نیروی جاذبه ی الکتروستاتیکی قوی که برای اتصال و نگه داشتن دوبار ناهمنام که معمولاً کاتیون و آنیون هستند به کار گرفته می شود، به عنوان پیوند یونی تعریف می گردد.
پیوند های یونی برای پایه ی انتقال الکترون می باشند.
خواص ترکیب های یونی
الف- رسانایی الکتریکی :
رسانایی الکتریکی مواد مرکب یونی مذاب به این علت است که وقتی قطبهایی با بار مخالف در این مواد مذاب قرار گیرد و میدان الکتریکی برقرارشود، یون ها آزادانه به حرکت در میآیند. این حرکت یونها بار یا جریان را از یکجا به جای دیگر منتقل میکنند. در جسم جامد که یونها بیحرکتاند و نمیتوانند آزادانه حرکت کنند، جسم خاصیت رسانای الکتریکی ندارد.
ب- سختی :
سختی مواد مرکب یونی به علت پیوند محکم
میان یونهای با بار مخالف است. برای پیوندهای قوی انرژی بسیاری لازم است
تا یونها از هم جدا شوند و امکان حرکت آزاد حالت مذاب را پیداکنند. انرژی
زیاد به معنی نقطه جوش بالا است که خود از ویژگیهای مواد مرکب یونی است.
ج- شکنندگی :
مواد
مرکب یونی شکنندهاند. زیرا که ساختار جامد آنها آرایه منظمی از یونهاست.
مثلا ساختار سدیم کلرید (NaCl) را در نظر بگیرید. هرگاه یک سطح از یونها
فقط به فاصله یک یون در هر جهت جابجا شود، یونهایی که بار مشابه دارند
درکنار یکدیگر قرار میگیرند و یکدیگر را دفع میکنند و چون جاذبهای در
کار نیست بلور میشکند. سدیم کلرید را نمیتوان با چکش کاری ، به ورقههای
نازک تبدیل کرد. با چنین عملی بلور نمک خرد و از هم پاشیده میشود.
پیوند کووالانس کئوردینانس (داتیو)
هریک از دواتم شرکت کننده در پیوند کووالانسی یک الکترون به اشتراک می گذارند. وبه طوری که نمی توان تشخیص داد که الکترون های پیوندی متعلق به کدام اتم بوده است .ولی یک نوع پیوند کووالانسی دیگروجود دارد٬که درآن یک اتم دوالکترون پیوندی ( دهنده الکترون ) راتامین می کند واتم دیگر که الکترون کم دارد (پذیرنده الکترون) این دوالکترون را می گیرد .این پیوندکووالانسی را داتیو ( کووالانس کئوردینانسی ) می نامند.
کلمهی داتیو به زبان یونانی یعنی بخشنده این پیوند زمانی تشکیل میشود که یک اتم دارای زوج الکترون تنها و اتم دیگر اوربیتال خالی داشته باشد.
پیوند داتیو
شرط تشکیل پیوند داتیو:در تشکیل پیوند داتیو باید اتمی که الکترون به اشتراک میگذارد، در آخرین لایه ، حداقل یک جفت الکترون غیر پیوندی داشته باشد و اتم دیگر نیز حداقل دارای یک اوربیتال خالی در آخرین لایه باشد ).اوربیتال: فضایی است که احتمال حضور بیشترین الکترون را داشته باشد .)
اتم نیتروژن با سه اتم هیدروژن ، پیوند کووالانسی معمولی تشکیل میدهد و به آرایش الکترونی گاز بیاثر میرسد. پس از این عمل ، برای نیتروژن یک جفت الکترون غیر پیوندی باقی میماند که میتواند آن را بصورت داتیو در اختیار اتمهایی که به آن نیاز دارند، قرار دهد. از سوی دیگر ، اتم هیدروژن که یک
الکترون در اوربیتال آن موجود است، هر گاه این الکترون را از دست بدهد، به یون H+تبدیل میشود که اوربیتال 1S آن خالی است.حال هرگاه این یون به مولکول آمونیاک نزدیک شود، با آن پیوند داتیو برقرار میکند و خود را به آرایش الکترونی گاز بیاثر میرساند (NH4+) این مجموعه که یون آمونیوم نامیده میشود، در بسیاری از ترکیبات مانند کلرید آمونیومNH4Cl) ) و هیدروکسید آمونیوم(NH4OH) وجود دارد.
اندازه گیریهای انجام شده نشان میدهد که انرژی و طول هر چهار پیوند نیتروژن _ هیدروژن در یون آمونیوم کاملا یکسان است. این امر منطقی نیز به نظر میرسد، زیرا پیوند داتیو نیز مانند پیوند کووالانسی معمولی یک جفت الکترون است که بین هسته اتم نیتروژن و هسته اتم هیدروژن قرار گرفته استکلرید آلومینیوم نیز با یون Cl- ترکیب میشود و یون AlCl 4-تولید میکند که در آن هر چهار پیوند AL - Cl از نظر طول و انرژی یکسان هستند.
پیوند هیدروژنی:
در این جا هیدروژن با عناصر الکترونگاتیوی نظیر فلوئور، اکسیژن و نیتروژن ترکیب می شود ( مانند مولکول آب H2O ،آمونیاک NH3 ). بنابراین ابر الکترونی بین اتم های درگیر در پیوند، بیشتر به سمت اتم های الکترونگاتیو که قدرت جذب الکترون را دارند، تمایل پیدا می کند.
هرگاه هیدروژن به اتمی با الکترونگاتیوی زیاد مثل فلوئور ، اکسیژن یا نیتروژن
متصل گردد، شرایطی برای بوجود آمدن نوع بسیاری مهمی جاذبه بین مولکولی
مثبت ـ منفی که آن را پیوند هیدروژنی میگویند حاصل میشود. به عبارت دیگر ،
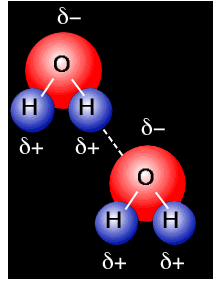
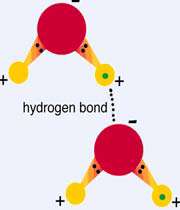
اتم هیدروژن یک مولکول و زوج الکترون غیر مشترک مولکول دیگر متقابلا همدیگر را جذب میکنند و پیوندی تشکیل میشود که به پیوند هیدروژنی ، Hydrogen Bond مرسوم است.
اطلاعات اولیه
جاذبه بین مولکولی دربرخی از ترکیبات هیدروژندار بطور غیرعادی قوی است. این جاذبه در ترکیباتی مشاهده میشود که درآنها بین هیدروژن و عناصری که اندازه کوچک و الکترونگاتیویته زیاد دارند، پیوند هیدروژنی وجود دارد. پیوند هیدروژنی نه تنها بین مولکولهای یک نوع ماده ، بلکه بین مولکولهای دو ماده متفاوت که توانایی تشکیل پیوند هیدروژنی را دارند نیز برقرار میشود.نحوه تشکیل پیوند هیدروژنی
پیوند هیدروژنی بر اثر جاذبه اتم هیدروژن اندک مثبت موجود در یک مولکول و اتم بسیار الکترونگاتیو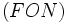 موجود در مولکول دیگر (یا در محل دیگر همان مولکول اگر مولکول به قدر کافی
بزرگ باشد که بتواند روی خود خم شود) تولید میگردد. جا به جا شدن یک جفت الکترون به سمت عنصر بسیار الکترونگاتیو نیتروژن ، اکسیژن یا فلوئور موجب میشود که این اتمها دارای بار منفی جزئی شوند.
موجود در مولکول دیگر (یا در محل دیگر همان مولکول اگر مولکول به قدر کافی
بزرگ باشد که بتواند روی خود خم شود) تولید میگردد. جا به جا شدن یک جفت الکترون به سمت عنصر بسیار الکترونگاتیو نیتروژن ، اکسیژن یا فلوئور موجب میشود که این اتمها دارای بار منفی جزئی شوند.در این صورت پیوند هیدروژنی پلی است میان دو اتم شدیدا الکترونگاتیو با یک اتم هیدروژن که از طرفی بطور کووالانسی با یکی از اتمهای الکترونگاتیو و از طرف دیگر بطور الکترواستاتیکی (جاذبه مثبت به منفی) با اتم الکترونگاتیو دیگر پیوند یافته است. استحکام پیوند هیدروژنی یکدهم تا یکپنجاهم قدرت یک پیوند کوالانسی متوسط است.
شرایط تشکیل پیوند هیدروژنی
-
بالا بودن الکترونگاتیوی اتمهای متصل به هیدروژن:
برهمین اساس است که فلوئور (الکترونگاتیوترین عنصر) ، قویترین پیوند
هیدروژنی و اکسیژن (الکترونگاتیوتر از نیتروژن) ، پیوند هیدروژنی قویتری
درمقایسه با نیتروژن تشکیل میدهد. همچنین بار مثبت زیاد بر روی اتم
هیدروژن ، زوج الکترون مولکول دیگر را بشدت جذب میکند و کوچک بودن اندازه
اتم هیدروژن سبب میشود که ملکول دوم بتواند به آن نزدیک شود.
- کوچک بودن اتمهای متصل به هیدروژن : پیوند هیدروژنی واقعا مؤثر فقط در ترکیبات فلوئور ، اکسیژن و نیتروژن تشکیل میشود. با وجود اینکه دو اتم نیتروژن و کلر ، الکترونگاتیوی برابر دارند، چون اتم کلر از اتم نیتروژن بزرگتر است بر خلاف نیتروژن ، کلر پیوند هیدروژنی ضعیفی تشکیل میدهد.
توجیه خواص غیرعادی برخی از مواد
وجود خواص غیرعادی برخی از مواد در حالت جامد یا مایع از جمله بالا بودن دماهای ذوب و جوش ، نشان میدهد که نیروهای جاذبه بین مولکولی در آنها به اندازهای زیاد است که نمیتوان آن را به تأثیرهای متقابل ضعیف بین مولکولی نسبت داد. آشناترین این نوع مواد ، فلوئورید هیدروژن ، آب و آمونیاک است که بسیاری از خواص آنها از جمله دماهای جوش و ذوب آنها از دماهای جوش و ذوب ترکیبهای مشابه خود ، برای مثال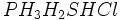 بطور غیرمنتظرهای بالاتر است.
بطور غیرمنتظرهای بالاتر است.شاید تصور شود که علت این وضعیت غیر عادی ، قطبیت به نسبت زیاد این مولکولهاست. البته تا اندازهای همین طور است. اما بررسی دقیق این پدیده غیر عادی نشان میدهد که باید نیروی جاذبه قویتر از نیروهای جاذبه دوقطبی _ دوقطبی بین مولکولهای آنها برقرار باشد.
اگر به ساختار الکترونی مولکولهای
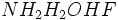 توجه شود، میتوان به موردهای مشترک بین آنها پی برد. این وجه اشتراک ، وجود دست کم یک پیوند کوالانسی با اتم هیدروژن و یک اوربیتال هیبریدی ناپیوندی دو الکترونی اتم مرکزی بسیار الکترونگاتیو در هر یک از آنهاست.
توجه شود، میتوان به موردهای مشترک بین آنها پی برد. این وجه اشتراک ، وجود دست کم یک پیوند کوالانسی با اتم هیدروژن و یک اوربیتال هیبریدی ناپیوندی دو الکترونی اتم مرکزی بسیار الکترونگاتیو در هر یک از آنهاست.اتمهای
 الکترونگاتیوی بالایی دارند با هیدروژن پیوند کوالانسی بشدت قطبی بوجود میآورند، بطوری که هیدروژن به میزان قابل توجهی خصلت یک پروتون
را پیدا میکند. جفت الکترون ناپیوندی و قابل واگذاری روی اتم
الکترونگاتیو H ، این امکان را پدید میآورد که اتم هیدروژن در نقش پل ،
اتمهای الکترونگاتیو دو مولکول را به یکدیگر متصل کند و نیروی جاذبه بین مولکولی بوجود میآید که به پیوند هیدروژنی مرسوم است.
الکترونگاتیوی بالایی دارند با هیدروژن پیوند کوالانسی بشدت قطبی بوجود میآورند، بطوری که هیدروژن به میزان قابل توجهی خصلت یک پروتون
را پیدا میکند. جفت الکترون ناپیوندی و قابل واگذاری روی اتم
الکترونگاتیو H ، این امکان را پدید میآورد که اتم هیدروژن در نقش پل ،
اتمهای الکترونگاتیو دو مولکول را به یکدیگر متصل کند و نیروی جاذبه بین مولکولی بوجود میآید که به پیوند هیدروژنی مرسوم است.
خواص ترکیبات دارای پیوند کووالانسی
ترکیباتی که مولکولهای آنها از طریق پیوند هیدروژنی به همدیگر پیوستهاند، علاوه بر دارا بودن نقاط جوش بالا ، بطور غیرعادی در دمای بالا ذوب میشوند و آنتالپی تبخیر ، آنتالپی ذوب و گرانروی آنها زیاد است.علت شناور بودن یخ
یخ روی آب شناور میماند، زیرا به هنگام انجماد ، منبسط میشود. سبب این انبساط پیوند هیدروژنی میان مولکولهای خمیده آب است ساختار خمیده یا زاویهای مولکول آب ناشی از آرایش چهار وجهی چهار جفت الکترون در لایه ظرفیت یک اتم است. ساختار زاویهای مولکول آب و پیوند هیدروژنی میان مولکولهای آب به آن معنی است که هر مولکول آب میتواند حداکثر با چهار مولکول آب دیگر پیوند هیدروژنی داشته باشد.پس آب مایع را میتوان به صورت خوشههایی از مولکولهای آب تصورکرد، خوشههایی که با پیوند هیدروژنی از مولکولهای آب ساخته شدهاند و دائم در حال حرکتند. شمار مولکولها در هر خوشه و سرعت حرکت خوشهها به دما بستگی دارد. با سرد شدن آب ، مجموعههایی از مولکولهای آب که بسرعت در حرکتاند، کند میشوند و در نقطه انجماد به یکدیگر قلاب شده ساختمان سه بعدی منبسط شدهای را بوجود میآورند. این ساختمان گستردهتر موجب میشود که تراکم یخ کمتر از آب باشد.
ذوب شدن یخ در حدود 15% انرژی پیوندهای هیدروژنی را میشکند و این امر سبب فرو ریختن ساختار میشود. در نتیجه مایعی متراکم حاصل می گردد.
چرا نقطه جوش آب بالا است؟
خاصیت عجیب دیگر آب ، نقطه جوش نسبتا زیاد آن است. تقریبا تمام ترکیبات هیدروژندار مجاور اکسیژن و اعضای خانواده آن یعنی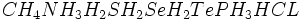 در دمای اتاق به حالت گازی هستند. اما آب مایع است. برای آنکه یک مولکول به حالت بخار
در آید، باید انرژی جذب کند تا بتواند خود را از قید مولکولهای دیگر آزاد
کند. چون آب مایع با پیوند هیدروژنی به صورت خوشههایی از مولکولها در
میآید، برای شکسته شدن پیوندهای هیدروژنی آن ، انرژی زیادی لازم است.
در دمای اتاق به حالت گازی هستند. اما آب مایع است. برای آنکه یک مولکول به حالت بخار
در آید، باید انرژی جذب کند تا بتواند خود را از قید مولکولهای دیگر آزاد
کند. چون آب مایع با پیوند هیدروژنی به صورت خوشههایی از مولکولها در
میآید، برای شکسته شدن پیوندهای هیدروژنی آن ، انرژی زیادی لازم است.اما همه پیوندهای هیدروژنی شکسته نمیشوند و خوشههایی از مولکولهای آب حتی در نزدیکی 1000 درجه سانتیگراد هنوز وجود دارند. وقتی آب گرم میشود، آشفتگی گرمایی پیوند هیدروژنی را میگسلد تا آنکه در بخار آب ، فقط جزء کوچکی از شمار پیوندهای هیدروژنی موجود در آب مایع یا جامد باقی میماند. اگر پیوند محکم میان مولکولی از قبیل پیوند هیدروژنی وجود نداشته باشد، مواد معمولا بنا به جرم مولکولی خود به جوش میآیند.
جرمهای مولکولی بزرگتر برای جوش آمدن به دمای زیادتری نیازمندند. عمدتا به این دلیل که ابرهای الکترونی بزرگتر آسانتر و پیچیده میشوند و این امر ، منجر به نیروهای لاندن بین مولکولی قویتر میشود.
کاربردهای پیوند هیدروژنی
پیوندهای هیدروژنی در بسیاری از مواد یافت میشوند. پدیدههایی از قبیل چسبناک شدن آبنبات سفت ، دیرتر خشک شدن الیاف پنبهای از الیاف نایلونی ، نرم شدن پوست با نایلون ، ناهنجارهای ظاهری در ماهیت آب ، همگی ناشی از همین پیوندهای هیدروژنی است.پیوند هیدروژنی در تعیین ساختار و خواص مولکولهای سیستمهای زنده نقش اساسی دارد. اجزای مارپیچ آلفا در ساختار پروتئینها و اجزای مارپیچ دوگانه در ساختار DNA توسط پیوند هیدروژنی بهم میپیوندند. تشکیل و گسسته شدن پیوندهای هیدروژنی در تقسیم یافتن و سنتز پروتئینها توسط آن دارای اهمیت اساسی است.
پیوند فلزی:
پیوند فلزی: نیروی جاذبهای که از تأثیر متقابل الکترونهای غیر مستقر (یعنی همان الکترونهای لایهی ظرفیت) و ذرههای مثبت شبکهی بلور فلز به وجود میآید عامل پیدایش پیوند فلزی میباشد
فلزات به وسیلة رسانایی الکتریکی بالا، جلای فلزی و چکشخواری مشخص میشوند. کدام آرایش پیوندی میتواند پدید آورندة این خواص باشد؟ فلزات در حالت جامد بلورهایی تشکیل میدهند که در آنها هر اتم با هشت یا دوازده اتم فلز احاطه شده است.
نظر به این که فلزات در تراز بیرونی خود فقط 1،2 یا 3 الکترون دارند، اتم های آنها با اتم های مجاور خود پیوندهای کووالانسی عادی تشکیل نمیدهند و چون اتمهای یک عنصر نیروی جاذبة یکسانی نسبت به الکترونهای خود دارند، اتم های فلز تمایلی به تشکیل یون در بلور فلز ندارند. در اینجا، بلور فلز وقتی تشکیل میشود که اتمها در کنار یکدیگر جمع میشوند و اوربیتال های تراز بیرونی تمام اتم ها با یکدیگر همپوشانی میکنند. در این حالت الکترون ها میتوانند به راحتی از یک اتم به اتم دیگر حرکت کنند. در اینجا گفته میشود که الکترون ها غیرمستقرند زیرا این الکترونها در یک «مکان» به عنوان
بخشی از یک یون یا پیوند کووالانسی معین قرار نگرفتهاند. اگر یک میدان الکتریکی خارجی اعمال کنیم، الکترونها در درون فلز به جریان میافتند و جریان الکتریکی به وجود میآید. الکترونها غیرمستقر به آسانی با نور بر هم کنش داشته، جلای فلزی را به وجود میآورند. وقتی فلزات را با چکش میکوبیم، اتمها تغییر آرایش میدهند و الکترونها نیز در اوربیتالهای اتمها در مکانهای جدید جابجا میشوند. الکترونهای غیرمستقر که اتمهای فلزی را به یکدیگر متصل نگه میدارند پیوند فلزی را به وجود میآورند.
خواص فلزات با تعداد الکترونهای بیرونی آنها معین میشود. فلزات گروه (IA)1 در هر اتم فقط یک الکترون بیرونی دارند. این فلزات نرم هستند. فلزات گروه(IIA)2 دو الکترون بیرونی دارند و در مقایسه با فلزات گروه (IA)1 سختترند. اما، در فلزات واسطه، الکترونهای اوربیتالهای d ممکن است در تشکیل پیوند فلزی شرکت کنند. بسیاری از این فلزات بسیار سخت هستند.
عناصر گروه (IIIB) 3 تا (VIB)6 سه تا شش الکترون غیرمستقر دارند. در عناصر گروههای (VIIB)7 تا (VIIIB)10، تعداد الکتروهای غیرمستقر همان شش الکترون است زیرا الکترونهای تراز فرعی d این عناصر در پیوند فلزی شرکت ندارند. تعداد الکترونهای غیرمستقر به ازای هر اتم با فلزات گروههای (IB)11 و (IIB)12 رو به نقصان میگذارد. گروههای (IIIA)13 تا (VIIIA)18، نافلزند و از خواص فلزی آنها به سرعت کاسته میشود.
پیوند فلزی قوی در فلزات ساختمانی مانند آهن، کروم و نیکل، این فلزات را سخت و محکم ساخته است. به طورکلی، عناصر واسطه، سختترین و محکمترین عناصر هستند. بعضی از فلزات که الکترونهای غیرمستقر کمتری دارند را میتوان با سایر فلزات ترکیب کرد و آلیاژ تشکیل داد و به این ترتیب باعث استحکام فلز شد. خواص این آلیاژها از خواص عناصر خالص سازندة آلیاژ متفاوت است.
فلزات معمولاً به دلیل انرژی یونیزاسیون پایین می توانند الکترون ها را در خارجی ترین لایه ی خود، به راحتی از دست دهند. آرایش عناصر فلزی بدین صورت است که شبکه ی آن متشکل از اتم خنثی و اتم یونیزه ( اتم هایی که تعدادی از الکترون های ظرفیتی خود را از دست داده اند ) می باشد.
انتقال الکترون از اتم خنثی به اتم یونیزه به راحتی صورت می گیرد. بنابراین در این جا دائماً مبادله ی الکترون انجام می شود و همیشه تعدادی الکترون آزاد در شبکه وجود داشته و این الکترون ها در لحظه مشخصی به اتم به خصوصی تعلق ندارند.
بنابراین می توان شبکه فلزی را یک کریستال سه بعدی متشکل از اتم های خنثی و یون های مثبت دانست که در اتمسفری از گاز الکترون یا دریایی از الکترون های غیر مستقر ، قرار گرفته اند.

 محمد دهقانی
محمد دهقانی