هرگاه موادی به مواد جدید تبدیل شوند...

|
چگونگی انجام یک واکنش شیمیایی
برای اینکه واکنش شیمیایی رخ دهد، باید پیوندهای بین اتمها و مولکولها شکسته شوند و به نحو دیگری تشکیل شوند. از آنجا که این پیوندها معمولا قوی هستند، اغلب برای شروع یک واکنش انرژی لازم است. این انرژی معمولا به شکل گرما است. مواد جدید (محصولات واکنش) خواص متفاوت با مواد اولیه (واکنش دهنده ها) دارند. واکنشهای شیمیایی فقط در آزمایشگاه رخ نمیدهند. این واکنشها دائما در اطراف ما در حال وقوع اند، مانند زنگ زدن اتومبیلها و پخته شدن غذا.انواع واکنشهای شیمیایی
بعضی از واکنشهای شیمیایی بسیار سریع، یعنی ظرف چند ثانیه رخ میدهند. بعضی دیگر از واکنشها بسیار کند هستند و تا هزاران سال به طول میانجامند (فساد یک جسد مومیایی شده باستانی نمونه ای از واکنشهای بسیار کند است).نحوه انجام واکنش
برای اینکه یک واکنش شیمیایی رخ دهد، باید مواد واکنشدهنده با هم تماس یابند تا محصولات جدیدی را تشکیل دهند. هر چیزی که تماس بین ذرات واکنشدهنده را افزایش دهد، سرعت واکنش را زیاد میکند. این کار را به چند طریق میتوان انجام داد:- با افزایش غلظت
واکنشدهندهها ، بطوری که ذرات بیشتری وجود داشته باشد. به این ترتیب
ذرات به دفعات بیشتری به هم برخورد میکنند و بنابر این سریعتر واکنش
میکنند و محصولات واکنش را تشکیل میدهند.
- با افزایش فشار درون ظرف واکنش ، بطوری که ذرات به هم فشرده شوند و در نتیجه بیشتر به هم برخورد کنند.
- با افزایش دمایی که واکنش در آن رخ میدهد. این کار به ذرات انرژی
بیشتری میدهد، در نتیجه سریعتر حرکت میکنند و به دفعات بیشتری برخورد
میکنند.
- با افزایش مساحت رویه واکنشدهندهها با شکستن فیزیکی آنها. این کار فرصت بیشتری را برای تماس و واکنش به واکنشدهندهها میدهد.

|
استفاده از کاتالیزور
راه دیگری برای تغییر سرعت یک واکنش استفاده از کاتالیزور است. کاتالیزور ماده ای است که سرعت یک واکنش را تغییر میدهد، اما خود آن در پایان واکنش از نظر شیمیایی بدون تغییر میماند. کاتالیزگرها معمولا واکنش را سریعتر میکنند. این مواد این کار را با فراهم کردن مسیر دیگری برای واکنش انجام میدهند، مسیری که نیاز به انرژی کمتری دارد.به دلیل پائین آمدن «سد» انرژی ذرات بیشتری واکنش میکنند و واکنش سریعتر انجام میشود. کاتالیزگرها در تولید صنعتی مواد مختلف، مانند بنزین ، مارگارین ، آمونیاک اهمیت زیادی دارند. اکثر کاتالیزگرهای صنعتی فلز هستند و به شکل دانه های فلزاند. بعضی از کاتالیزگرها برای کند کردن واکنشها به کار میروند و بازدارنده نامیده میشوند.
اکسایش و کاهش
اکسایش و کاهش فرایندهایی هستند که در بعضی واکنشهای شیمیایی رخ میدهند: وقتی که اکسیژن به ماده ای اضافه میشود، وقتی که ماده ای هیدروژن از دست میدهد و وقتی که ماده ای الکترون از دست میدهد.کاهش ، عکس اکسایش است. این فرایند در سه حالت رخ میدهد: وقتی که ماده ای اکسیژن از دست میدهد، وقتی که ماده ای هیدروژن بدست میآورد و وقتی که مادهای الکترون بدست می آورد.
به عنوان مثال وقتی که منیزیم در هوا سوزانده میشود، این فلز با به دست آوردن اکسیژن و اکسیده شدن تبدیل به خاکستر میشود. این خاکستر اکسید منیزیم است.
واکنشهای اکسایش و کاهش
اکسایش و کاهش همیشه همراه با هم در یک واکنش رخ میدهند.در این صورت، واکنش را واکنش اکسایش- کاهش مینامند. بعضی از واکنشهای اکسایش- کاهش در صنعت مفید است. مثلا استخراج آهن از سنگ معدن آن با ترکیب کردن سنگ معدن با منواکسید کربن در کوره بلند آهن انجام میشود. در این واکنش سنگ معدن آهن اکسیژن از دست میدهد و آهن تشکیل میشود و منواکسید کربن ، اکسیژن بدست میآورد و تبدیل به دیاکسید کربن میشود.واکنش های گرمازا
دید کلی بسیاری از واکنشهای شیمیایی با آزاد کردن انرژی همراه هستند. این انرژی آزاد شده میتواند بصورت گرما ، نور یا صدا باشد. چنین واکنشهایی را واکنش گرماده میگویند. روزانه از واکنشهای گرماده زیادی برای منظورهای مختلف استفاده میکنیم. سادهترین این واکنشها روشن کردن کبریت است که واکنشی بین اکسیژن هوا و ماده آتشگیر آن رخ میدهد که با آزاد کردن نور و گرما همراه است. سوختهای طبیعی ترکیبات پیچیدهای از کربن و هیدروژن هستند. وقتی که این مواد در اکسیژن میسوزند دیاکسید کربن ، آب و حرارت ایجاد میکنند.
برخی از سوختها مانند هیدروژن و مواد منفجره مانند TNT و دینامیتها در اثر واکنش ظرفیتهای بالایی از انرژی را در مدت زمان کوتاهی آزاد میکنند، بنابراین انفجار را میتوان واکنش گرماده در نظر گرفت که انرژی زیادی را بصورت گرما ، صدا و نور در زمان کمتری آزاد میکند.

انجام واکنش گرماده از لحاظ تئوری
طبق قانون بقای انرژی ، انرژی از بین نمیرود اما بصورتهای دیگر تبدیل میشود، بنابراین انرژی یک سیستم مقدار ثابتی است. بعنوان مثال انرژی امروزی جهان با انرژی آن در هزاران سال پیش برابر است. واکنشهای شیمیایی با تغییر انرژی همراهاند. در یک واکنش وقتی پیوندهای ناپایدار با پیوندهای پایدارتری جایگزین میشوند مقداری انرژی آزاد میشود، بنابراین تشکیل پیوندهای پایدار با آزاد کردن انرژی همراه است و وقتی میلیونها پیوند پایدار در یک واکنش ایجاد میشود این انرژیها با هم جمع شده و انرژی بالایی را بصورت حرارت ، نور یا انفجار آزاد میکنند.بنابراین در یک واکنش گرماده سطح انرژی کمتر از سطح انرژی مواد واکنش دهنده است و گرمای آزاد شده را با آنتالپی منفی نمایش میدهند.
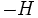
وقوع واکنشهای گرماده از لحاظ ترمودینامیکی
برخی از واکنشهای شیمیایی گرماده بصورت خود بخودی انجام میگیرند. میزان خود بخودی بودن یک واکنش را ΔG که معیاری از آنتروپی و محتوای آنتالپی است، مشخص میکند. اما پیشگویی خود بخودی بودن یک واکنش دلیل بر وقوع آن واکنش نیست. زیرا ترمودینامیک ، چیزی در مورد سرعت یک واکنش پیشبینی نمیکند. بعنوان مثال واکنش کربن با اکسیژن در دمای 25ْ و فشار 1 atm از لحاظ ترمودینامیکی قابل انجام است. اما بدون یک عامل موثر مثل حرارت ممکن است مخلوط کربن و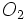 مدتهای مدیدی بدون تغییر باقی بماند.
مدتهای مدیدی بدون تغییر باقی بماند.تغییر آنتروپی یک محیط بر اثر گرمایی که بعلت تغییر آنتالپی واکنش به محیط یا از محیط منتقل میشود بوقوع میپیوندد. هر چه
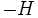 بزرگتر باشد بینظمی بیشتری در محیط ایجاد میشود.
بزرگتر باشد بینظمی بیشتری در محیط ایجاد میشود.پس در یک واکنش گرماده خود بخودی:
ΔG = ΔH -TΔs < 0
0> ΔH در یک واکنش گرمازا
Δs > 0 میزان بینظمی در یک واکنش خود بخودی
پس T.Δs > 0
آنگاه TΔs < 0- است. چون Δs برای یک تغییر خود بخود بزرگتر از صفر است و TΔs کل هم باید بزرگتر از صفر باشد در اینصورت
 بوده برای یک تغییر خود بخود
بوده برای یک تغییر خود بخود 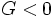 است. برای بسیاری از واکنشهای شیمیایی در 25 درجه سانتیگراد و فشار 1atm مقدار مطلق ΔH بسیار بزرگتر از مقدار TΔs میباشد در این شرایط واکنشهای گرمازا بصورت خود بخود صورت میگیرند.
است. برای بسیاری از واکنشهای شیمیایی در 25 درجه سانتیگراد و فشار 1atm مقدار مطلق ΔH بسیار بزرگتر از مقدار TΔs میباشد در این شرایط واکنشهای گرمازا بصورت خود بخود صورت میگیرند.
استفاده از واکنشهای گرمازا در صنعت
بیشتر کورههای احتراقی که عملیات گداختن و تصفیه کانی آهن و تولید آهن در آنها انجام میگیرد نیاز به دماهای بسیار بالا برای انجام واکنش دارند. در عملیات ذوب سنگ آهن ، سنگ آهن را با کک و سنگ آهک در کوره قرار داده و جریانی از هوای داغ را به درون کوره هدایت میکنند. واکنش کک ( کربن ) با اکسیژن بسیار گرمازا است. بنابراین این کورهها را از اکسیژن غنی میکنند. کک در اثر گرما هوای داغ با اکسیژن وارد واکنش شده و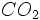 ایجاد میکند که از گرمای فراوان حاصل از این واکنش برای ذوب سنگ آهن استفاده میشود.
ایجاد میکند که از گرمای فراوان حاصل از این واکنش برای ذوب سنگ آهن استفاده میشود.
واکنش های گرماگیر
برخی از واکنشهای شیمیایی برای انجام و پیشرفت واکنش نیاز به جذب انرژی دارند این واکنشها را گرماگیر مینامند. فتوسنتز یکی از واکنشهای مهم گرماگیر میباشد که در این فرآیند ، گیاهان با استفاده از انرژی خورشید ، دیاکسید کربن و آب را به گلوکز و اکسیژن تبدیل میکنند. در این واکنش برای تولید یک کیلوگرم گلوکز به 15Mj انرژی خورشید نیاز میباشد.
آشنایی
بسیاری از کیسههای سرمازا که برای تخفیف درد در رگ به رگ شدن یک عضله یا پیچ خوردن پا مورد استفاده قرار میگیرند، حاوی کیسه کوچکی از نیترات آمونیوم در داخل کیسه بزرگتر که حاوی آب است، میباشد با فشار دادن کیسه سرمازا نیترات آمونیوم از کیسه خارج شده و وارد آب میشود و چون واکنش آن با آب گرماگیر میباشد گرمای لازم را از بدن شخص میگیرد. با گذاشتن این کیسهها در محل آسیب دیده ، موضع آسیب دیده سرد شده و فرد درد کمتری احساس میکند.بررسی ترمودینامیکی واکنش گرماگیر
وقتی میزان سطح انرژی در مواد اولیه پایینتر از محصولات باشد، واکنش به دلیل پایدار بودن مواد اولیه نیاز به انرژی دارد تا پیوندهای اولیه شکسته شده و پیوندهای جدید حاصل شوند در این صورت واکنش گرمای لازم را از محیط جذب میکند این تغییر انرژی را با (+ΔH) نشان میدهند. واکنشهای گرماگیر به صورت خود به خودی انجام نمیگیرند و برای انجام گرفتن واکنش نیاز به جذب انرژی یا انجام کار روی سیستم دارند.از لحاظ ترمودینامیکی برای یک واکنش گرماگیر ΔG>0 یعنی ΔG=ΔH - TΔS در نتیجه ΔH>0 میباشد. در یک واکنش غیر خود به خودی ΔS<0 میباشد. بنابراین TΔS>0- چون T(-ΔS)<0 و T(-ΔS)>0- پس ΔG>0 بوده و واکنش غیر خود به خودی میباشد.
